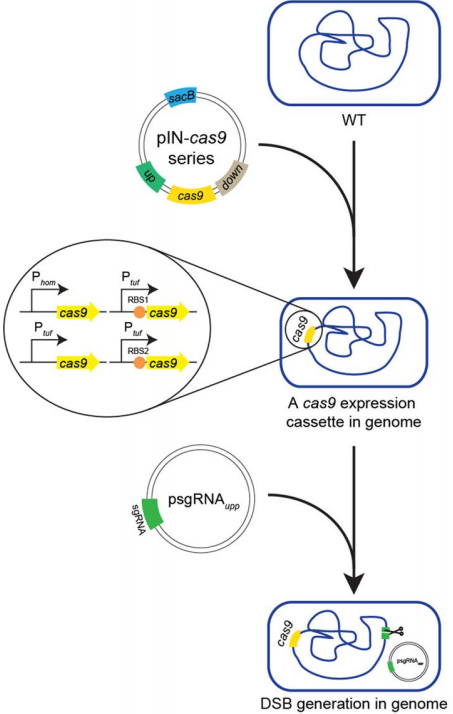
为了减少Cas9表达对细胞存活率的影响,在弱启动子Phom和rrnB终止子的控制下,将Cas9基因引入到转座酶(Cgl1066)位点的野生型谷氨酸梭菌ATCC 13032基因组中,产生菌株WT::Phom-Cas9。为了测试Cas9诱导的DSB的致死性,设计了靶向upp基因的sgRNA,并在强启动子PglyA的控制下将其插入pXMJ19ts中,从而产生质粒psgRNAupp。使用强启动子Ptuf来增加染色体cas9基因的转录。与Phom对照组相比,Ptuf对照组cas9的mRNA水平增加了4.93倍,导致逃逸率降低。然后,将翻译起始效率提高的两个核糖体结合序列(RBS1和RBS2)插入cas9基因起始密码子的前面,得到WT::Ptuf-RBS1-cas9和WT::Ptuf-RBS2-cas9菌株。这导致转化体数量大幅减少,证明了基于CRISPR/Cas9的反选择的可行性。选择编码尿嘧啶磷酸核糖基转移酶的upp基因作为靶基因。由于其失活导致5-氟尿嘧啶(5-FU)无法转化为对细胞生长有害产物,并产生了5-FU耐药表型,便于进行常规筛查。为了删除upp基因,将两个同源臂作为修复模板插入psgRNAupp中以构建pHAsgRNAup。当用pHAsgRNAupp转化到WT::Phom-cas9中时,21.79±5.88%的菌落通过菌落PCR得到证实,可以正确编辑upp基因,并相应地获得5-FU抗性。
参考文献:Wang B, Hu Q, Zhang Y, Shi R, Chai X, Liu Z, Shang X, Zhang Y, Wen T. A RecET-assisted CRISPR-Cas9 genome editing in Corynebacterium glutamicum. Microb Cell Fact. 2018 Apr 23;17(1):63.
技术服务 Technology Services
联系我们
CONTACT US
-
0574-87917803
服务热线 -
testobio@163.com
邮箱
为了减少Cas9表达对细胞存活率的影响,在弱启动子Phom和rrnB终止子的控制下,将Cas9基因引入到转座酶(Cgl1066)位点的野生型谷氨酸梭菌ATCC 13032基因组中,产生菌株WT::Phom-Cas9。为了测试Cas9诱导的DSB的致死性,设计了靶向upp基因的sgRNA,并在强启动子PglyA的控制下将其插入pXMJ19ts中,从而产生质粒psgRNAupp。使用强启动子Ptuf来增加染色体cas9基因的转录。与Phom对照组相比,Ptuf对照组cas9的mRNA水平增加了4.93倍,导致逃逸率降低。然后,将翻译起始效率提高的两个核糖体结合序列(RBS1和RBS2)插入cas9基因起始密码子的前面,得到WT::Ptuf-RBS1-cas9和WT::Ptuf-RBS2-cas9菌株。这导致转化体数量大幅减少,证明了基于CRISPR/Cas9的反选择的可行性。选择编码尿嘧啶磷酸核糖基转移酶的upp基因作为靶基因。由于其失活导致5-氟尿嘧啶(5-FU)无法转化为对细胞生长有害产物,并产生了5-FU耐药表型,便于进行常规筛查。为了删除upp基因,将两个同源臂作为修复模板插入psgRNAupp中以构建pHAsgRNAup。当用pHAsgRNAupp转化到WT::Phom-cas9中时,21.79±5.88%的菌落通过菌落PCR得到证实,可以正确编辑upp基因,并相应地获得5-FU抗性。

参考文献:Wang B, Hu Q, Zhang Y, Shi R, Chai X, Liu Z, Shang X, Zhang Y, Wen T. A RecET-assisted CRISPR-Cas9 genome editing in Corynebacterium glutamicum. Microb Cell Fact. 2018 Apr 23;17(1):63.







