质粒pEZ39p是通过用编码Z.mobilis ZM4中天然质粒pZM39的复制酶及其天然启动子的基因替换pEZ15A中Z.mobiris的复制起点而构建的。使用Gibson组装法构建质粒。使用与相邻DNA片段重叠15bp核苷酸的引物扩增靶基因。通过凝胶电泳分离片段,纯化试剂盒纯化。将靶片段与质粒载体以3:1的摩尔浓度比混合。然后,加入0.5 U T5核酸外切酶、0.5μL 10×缓冲液和Milli-Q超纯水,最终体积为5μL。将所有试剂混合并在冰上孵育5分钟。将30μL DH5α感受态细胞加入5-μL反应体系中,在冰上放置15分钟。将混合物在42℃水浴中加热45秒,然后在冰上冷却2分钟。pL2R在37°C下用BsaI消化过夜。间隔区是紧接在5′-CCC-3′PAM之后的32-bp序列。将寡核苷酸混合并加热至95°C 5分钟,然后在室温下退火。在18°C下,用T4连接酶将消化的线性DNA载体和退火间隔物酶联过夜。然后将连接后的产物转化到大肠杆菌DH5α感受态细胞中。供体被设计在长度约为800 bp的敲除基因的上游和下游。通过重叠PCR将两个供体片段连接到靶基因上,并用具有重叠区域的引物扩增这些片段。
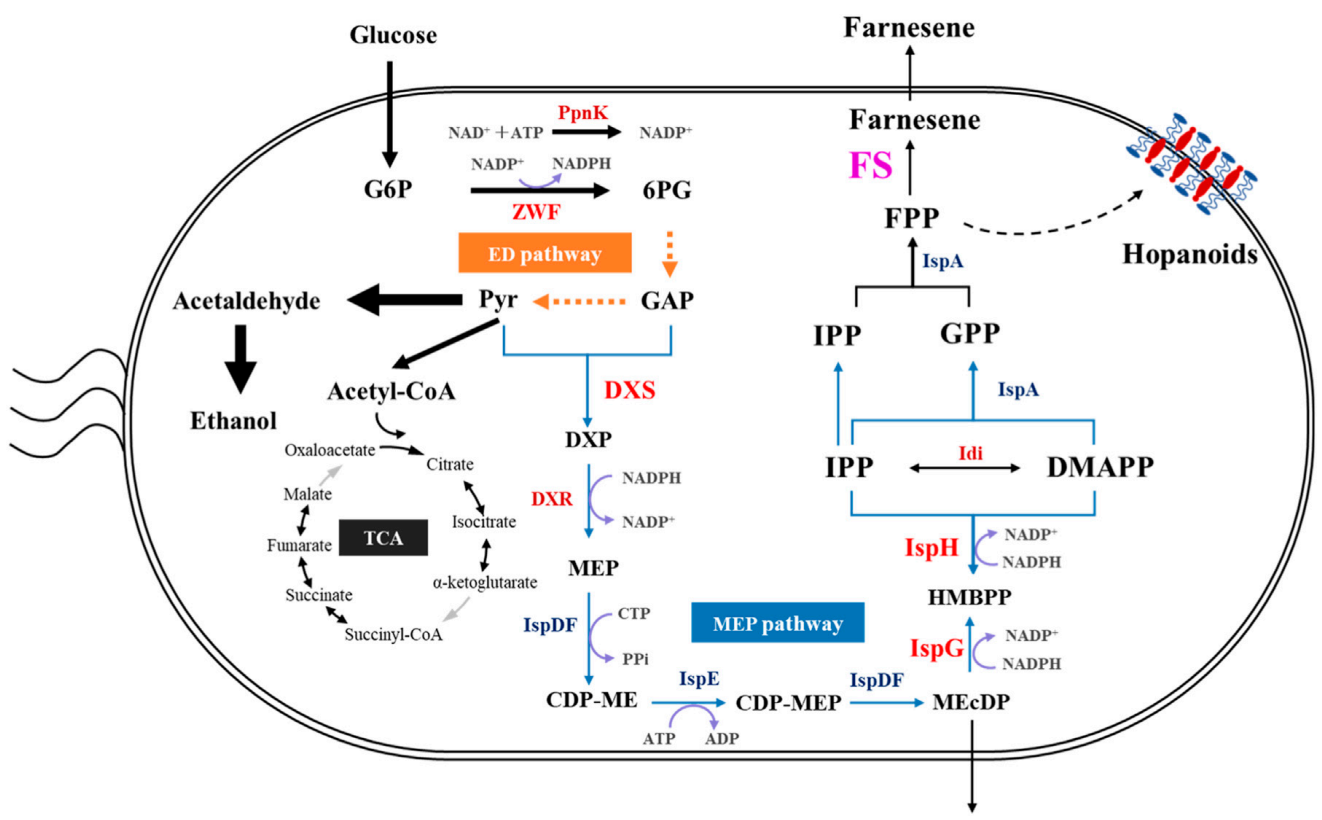
参考文献:Xiao Y, Tan X, He Q, Yang S. Systematic metabolic engineering of Zymomonas mobilis for β-farnesene production. Front Bioeng Biotechnol. 2024 May 17;12:1392556.
技术服务 Technology Services
联系我们
CONTACT US
-
0574-87917803
服务热线 -
testobio@163.com
邮箱
质粒pEZ39p是通过用编码Z.mobilis ZM4中天然质粒pZM39的复制酶及其天然启动子的基因替换pEZ15A中Z.mobiris的复制起点而构建的。使用Gibson组装法构建质粒。使用与相邻DNA片段重叠15bp核苷酸的引物扩增靶基因。通过凝胶电泳分离片段,纯化试剂盒纯化。将靶片段与质粒载体以3:1的摩尔浓度比混合。然后,加入0.5 U T5核酸外切酶、0.5μL 10×缓冲液和Milli-Q超纯水,最终体积为5μL。将所有试剂混合并在冰上孵育5分钟。将30μL DH5α感受态细胞加入5-μL反应体系中,在冰上放置15分钟。将混合物在42℃水浴中加热45秒,然后在冰上冷却2分钟。pL2R在37°C下用BsaI消化过夜。间隔区是紧接在5′-CCC-3′PAM之后的32-bp序列。将寡核苷酸混合并加热至95°C 5分钟,然后在室温下退火。在18°C下,用T4连接酶将消化的线性DNA载体和退火间隔物酶联过夜。然后将连接后的产物转化到大肠杆菌DH5α感受态细胞中。供体被设计在长度约为800 bp的敲除基因的上游和下游。通过重叠PCR将两个供体片段连接到靶基因上,并用具有重叠区域的引物扩增这些片段。

参考文献:Xiao Y, Tan X, He Q, Yang S. Systematic metabolic engineering of Zymomonas mobilis for β-farnesene production. Front Bioeng Biotechnol. 2024 May 17;12:1392556.







