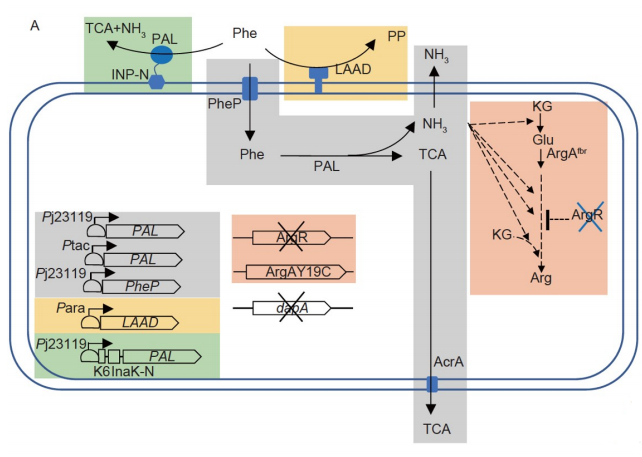
菌株构建思路:
评估了三种用于EcN中来自Photorhabdus的PAL表面显示的方法,携带编码PAL的stlA基因的质粒融合到三种不同表面显示系统的递送部分:
1. 枯草芽孢杆菌聚γ-谷氨酸合成酶复合物PgsA的C端,一种不寻常的阴离子多肽,其中谷氨酸通过γ-酰胺键聚合,
2. 脂蛋白Lpp-OmpA嵌合体的C端
3. 丁香假单胞菌INP的截短形式InaK N(N端结构域)。
表面显示系统由质粒pTrcHis2B上的Ptrc控制。结果表明,只有INP融合的PAL才能催化Phe转化为TCA。
之前报道的一种可以提高表面显示效率的带电肽6×Lys(K6)被添加到三种载体蛋白的N末端,发现只有K6-InaK-N-融合的PAL(K6INP-PAL)对Phe显示出明显的活性。考虑到诱导型Ptrc不适合未来的体内应用,它被组成型Pj23119所取代,该组成型Pj23119与Ptrc具有相似的转录活性,与不添加K6时相比,TCA的量增加了5.3倍,表明PAL活性的显著增加主要是融合K6的结果。
在比对来自不同菌种的PAL后显示发光假单胞菌的PAL使TCA的产量显著增加。
PAL在将Phe转化为TCA时放出氨,通过删除L-精氨酸生物合成的负调控因子argR来上调精氨酸的生物合成,并将L-精氨氨酸生物合成酶argA突变为反馈抗性突变体argAY19C。
构建方法:
1. 为了判断三种显示系统是否起作用,构建质粒Ptrc PgsA PAL、Ptrc LO PAL和Ptrc INP PAL。使用引物从枯草芽孢杆菌中PCR扩增PgsA基因;使用引物从大肠杆菌中扩增出lpp-ompA基因;从pUC inaK中扩增出inaK N基因;通过PCR从GenScript合成的pUC-stlA中扩增PAL基因。使用DNA组装试剂盒(TransGen Biotech)将所有DNA片段克隆到NcoI/HindIII线性化的pTrcHis2B载体中,以产生Ptrc PgsA PAL、Ptrc LO PAL和Ptrc INP-PAL。
2. 由Pj23119启动子控制的三个PAL拷贝被整合到malE/K、yicS/nepI和malP/T位点。将两个由tac启动子控制的PAL拷贝插入exo/cea和rhtC/B整合位点。将三个与inaK-N融合的表面显示PAL基因拷贝整合到dapA、betA和ybaP位点,使其由Pj23119启动子控制同时表达。将表达由Pj23119控制的大肠杆菌Phe转运蛋白的PheP的两个拷贝插入lacZ和agaI位点。编码由PBAD启动子控制的奇异青霉L-氨基酸脱氨酶的Pma的一个拷贝被整合到araBC位点。外排泵基因acrA或emrA被Pj23119启动子过表达。
3.将6×Lys添加到质粒Pj-K6INP-PAL的inaK-N的5′端,来自Ptrc INP PAL的inaK-N和PAL受Pj23119启动子控制。使用引物从pSU2718载体中扩增p15A复制子片段,使用Kan-FG/Kan-R(15A)引物从pPIC9k载体中PCR扩增卡那霉素抗性基因。采用CRISPR/Cas方法对ArgR进行缺失和ArgAY19C突变。
参考文献:Isabella VM, Ha BN, Castillo MJ, Lubkowicz DJ, Rowe SE, Millet YA, Anderson CL, Li N, Fisher AB, West KA, Reeder PJ, Momin MM, Bergeron CG, Guilmain SE, Miller PF, Kurtz CB, Falb D. Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nat Biotechnol. 2018 Oct;36(9):857-864. doi: 10.1038/nbt.4222. Epub 2018 Aug 13. PMID: 30102294.
技术服务 Technology Services
联系我们
CONTACT US
-
0574-87917803
服务热线 -
testobio@163.com
邮箱
菌株构建思路:
评估了三种用于EcN中来自Photorhabdus的PAL表面显示的方法,携带编码PAL的stlA基因的质粒融合到三种不同表面显示系统的递送部分:
1. 枯草芽孢杆菌聚γ-谷氨酸合成酶复合物PgsA的C端,一种不寻常的阴离子多肽,其中谷氨酸通过γ-酰胺键聚合,
2. 脂蛋白Lpp-OmpA嵌合体的C端
3. 丁香假单胞菌INP的截短形式InaK N(N端结构域)。
表面显示系统由质粒pTrcHis2B上的Ptrc控制。结果表明,只有INP融合的PAL才能催化Phe转化为TCA。
之前报道的一种可以提高表面显示效率的带电肽6×Lys(K6)被添加到三种载体蛋白的N末端,发现只有K6-InaK-N-融合的PAL(K6INP-PAL)对Phe显示出明显的活性。考虑到诱导型Ptrc不适合未来的体内应用,它被组成型Pj23119所取代,该组成型Pj23119与Ptrc具有相似的转录活性,与不添加K6时相比,TCA的量增加了5.3倍,表明PAL活性的显著增加主要是融合K6的结果。
在比对来自不同菌种的PAL后显示发光假单胞菌的PAL使TCA的产量显著增加。
PAL在将Phe转化为TCA时放出氨,通过删除L-精氨酸生物合成的负调控因子argR来上调精氨酸的生物合成,并将L-精氨氨酸生物合成酶argA突变为反馈抗性突变体argAY19C。
构建方法:
1. 为了判断三种显示系统是否起作用,构建质粒Ptrc PgsA PAL、Ptrc LO PAL和Ptrc INP PAL。使用引物从枯草芽孢杆菌中PCR扩增PgsA基因;使用引物从大肠杆菌中扩增出lpp-ompA基因;从pUC inaK中扩增出inaK N基因;通过PCR从GenScript合成的pUC-stlA中扩增PAL基因。使用DNA组装试剂盒(TransGen Biotech)将所有DNA片段克隆到NcoI/HindIII线性化的pTrcHis2B载体中,以产生Ptrc PgsA PAL、Ptrc LO PAL和Ptrc INP-PAL。
2. 由Pj23119启动子控制的三个PAL拷贝被整合到malE/K、yicS/nepI和malP/T位点。将两个由tac启动子控制的PAL拷贝插入exo/cea和rhtC/B整合位点。将三个与inaK-N融合的表面显示PAL基因拷贝整合到dapA、betA和ybaP位点,使其由Pj23119启动子控制同时表达。将表达由Pj23119控制的大肠杆菌Phe转运蛋白的PheP的两个拷贝插入lacZ和agaI位点。编码由PBAD启动子控制的奇异青霉L-氨基酸脱氨酶的Pma的一个拷贝被整合到araBC位点。外排泵基因acrA或emrA被Pj23119启动子过表达。
3.将6×Lys添加到质粒Pj-K6INP-PAL的inaK-N的5′端,来自Ptrc INP PAL的inaK-N和PAL受Pj23119启动子控制。使用引物从pSU2718载体中扩增p15A复制子片段,使用Kan-FG/Kan-R(15A)引物从pPIC9k载体中PCR扩增卡那霉素抗性基因。采用CRISPR/Cas方法对ArgR进行缺失和ArgAY19C突变。

参考文献:Isabella VM, Ha BN, Castillo MJ, Lubkowicz DJ, Rowe SE, Millet YA, Anderson CL, Li N, Fisher AB, West KA, Reeder PJ, Momin MM, Bergeron CG, Guilmain SE, Miller PF, Kurtz CB, Falb D. Development of a synthetic live bacterial therapeutic for the human metabolic disease phenylketonuria. Nat Biotechnol. 2018 Oct;36(9):857-864. doi: 10.1038/nbt.4222. Epub 2018 Aug 13. PMID: 30102294.







